阿普斯特片何时中国上市
562浏览
更新时间:2023-09-28
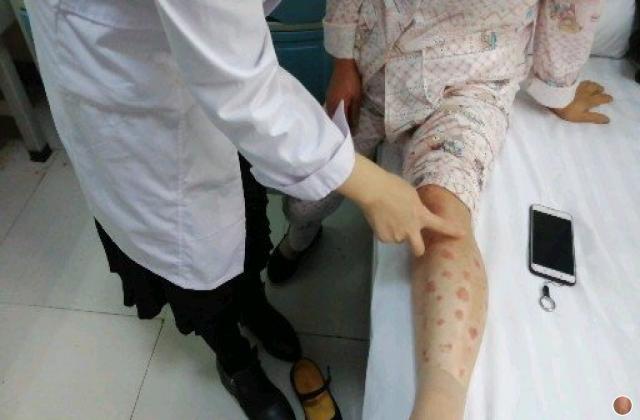
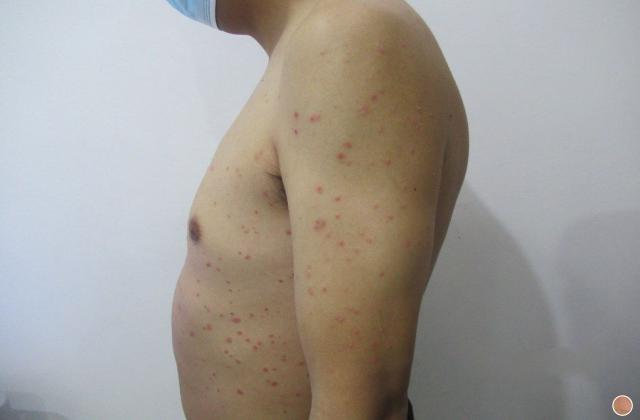
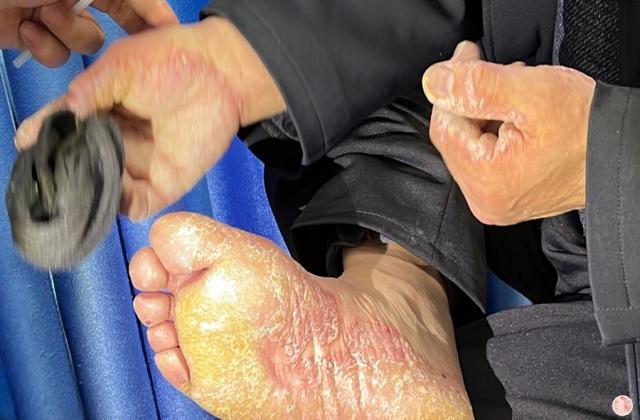
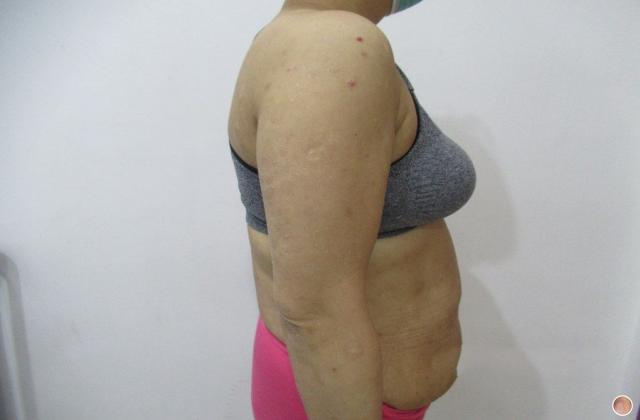
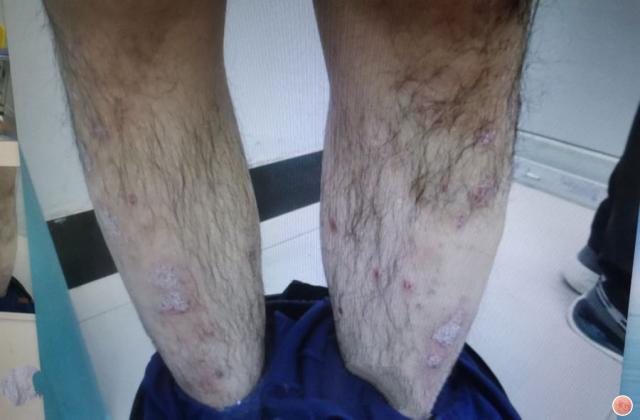
阿普斯特的研发和上市历经多年。它首先在2014年获得美国食品和药物管理局(FDA)的批准,作为治疗银屑病和关节炎的口服药物。之后,阿普斯特逐渐在全球范围内上市,如欧洲、澳大利亚、加拿大等地。然而,中国患者对于这种新药一直持有期待。
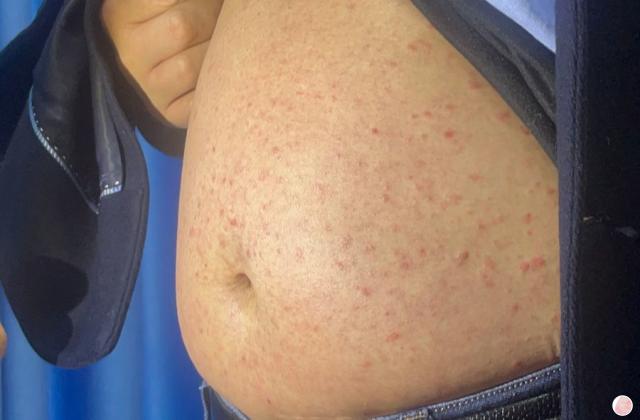
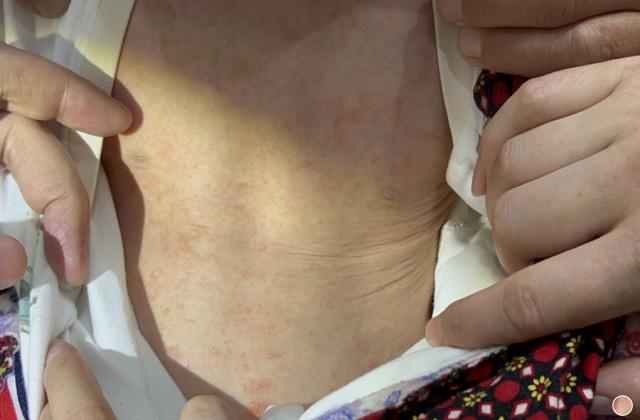
在中国,银屑病和关节炎患者数量庞大,同时也存在一定的缺乏有效治疗的问题。目前,市场上可用于治疗这两种疾病的药物选择有限,并且不同患者对药物的疗效和不良反应可能有所不同。因此,阿普斯特的上市对于中国患者来说是一个非常重要的里程碑。

然而,阿普斯特在中国的上市仍面临一些挑战。首先,中国的药物审批程序相对较为复杂,需要多个环节的审查和批准。这可能导致较长的时间周期,将测试患者的耐心推至极限。其次,阿普斯特可能遇到其他竞争对手的竞争,这些竞争对手可能是已经在中国市场上存在的药物,或是其他潜在的新药。最后,价格也可能成为上市的一大难题。中国政府一直在努力控制药物价格,在药品上市后的药价谈判可能会对阿普斯特的定价产生影响。
尽管面临这些挑战,许多人仍然对阿普斯特在中国的上市持有乐观态度。这种口服药物的便利性和相对较低的副作用使其成为患者的首选。此外,阿普斯特的疗效已在临床试验中得到证实,并已在其他国家获得批准。这为阿普斯特在中国的上市提供了一定的依据。
总之,阿普斯特作为一种新型口服药物,对于中国患者的治疗需求具有重要意义。尽管其在中国的上市仍然面临一些挑战,但许多人对其上市持有乐观态度。希望阿普斯特能尽快在中国上市,为中国患者提供更多的治疗选择。同时,希望中国相关部门能够推动药物审批流程的改革,加速新药上市的进程,以满足患者的治疗需求。
交流群
猜你喜欢
芩柏软膏治牛皮癣黑河治牛皮癣医院(黑河牛皮癣医院)银屑病留下色素沉淀怎么办抚顺市银屑病贴吧头上银屑病俗称头安康牛皮癣医院哪个最好(安康看牛皮癣哪个医院最好)薄荷软膏治银屑病 薄荷软膏治疗银屑病脸部湿疹涂什么药膏