美国FDA批准Skyrizi另一适应症,治疗银屑病关节炎
导语:银屑病关节炎是一种致残性慢性疾病,需长期治疗。近日,美国FDA批准Skyrizi用于治疗成人活动性银屑病关节炎(PsA),将为医护人员和患者提供一种新的治疗选择。
2022年1月24日,美国食品和药物管理局(FDA)批准Skyrizi®(risankizumab-rzaa,瑞莎珠单抗)用于治疗成人活动性银屑病关节炎(PsA)。Skyrizi也适用于中度至重度斑块型银屑病成人患者(适合系统治疗和光疗)的治疗。
该PsA适应症的批准是基于2项随机、双盲、安慰剂对照3期研究的数据,即KEEPsAKE-1 (NCT03675308)和KEEPsAKE-2 (nct03671148)试验,这两项研究比较了白介素-23拮抗剂瑞莎珠单抗 vs. 安慰剂治疗活动性PsA成人患者(对生物疗法和/或非生物性疾病修饰的抗风湿药物反应不充分或不耐受)的有效性和安全性。这两项研究的主要终点是在第24周达到美国风湿病学会(ACR) 20反应的患者比例。

KEEPsAKE-1和KEEPsAKE-2试验的结果显示,分别有57.3%和51.3%的患者接受瑞莎珠单抗150mg的治疗后在第24周达到了ACR20,而接受安慰剂治疗的患者达到ACR20的比例分别为34%和27%。与安慰剂相比,第24周时,瑞莎珠单抗还与ACR50和ACR70反应的改善有关。
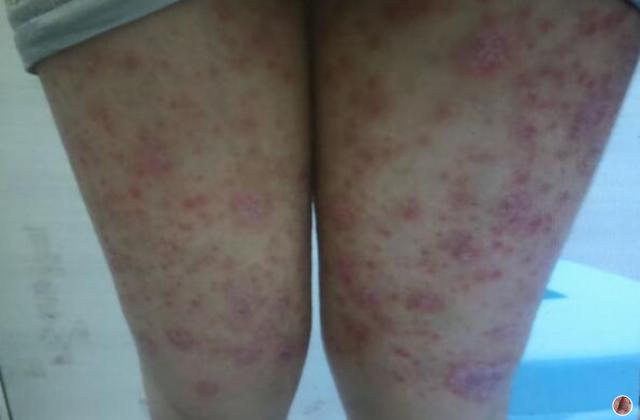
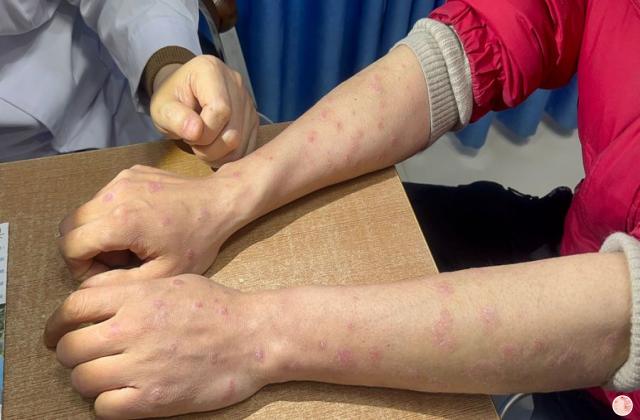
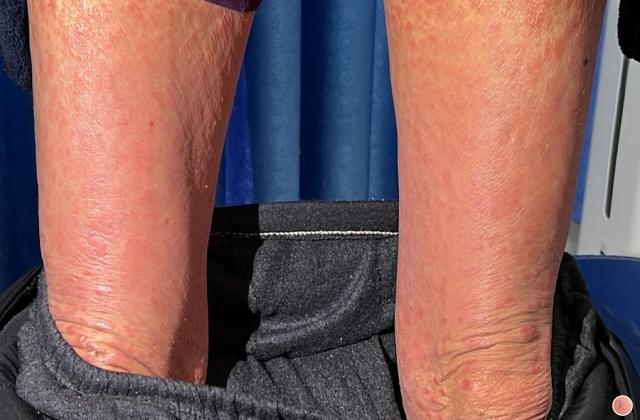
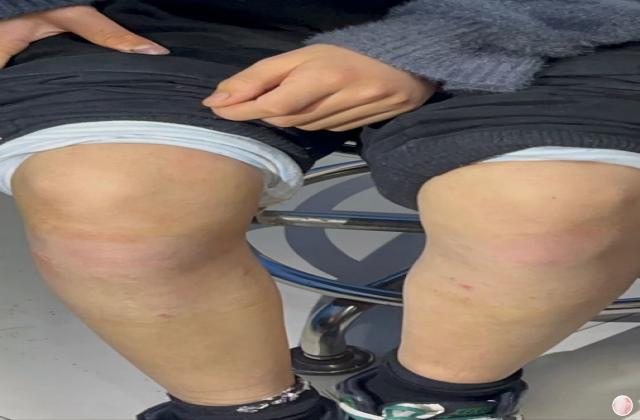
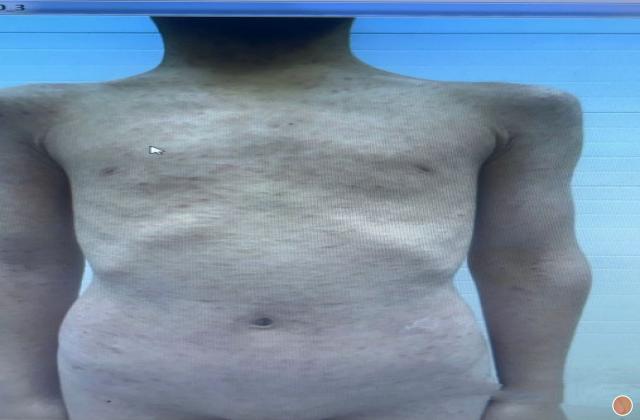
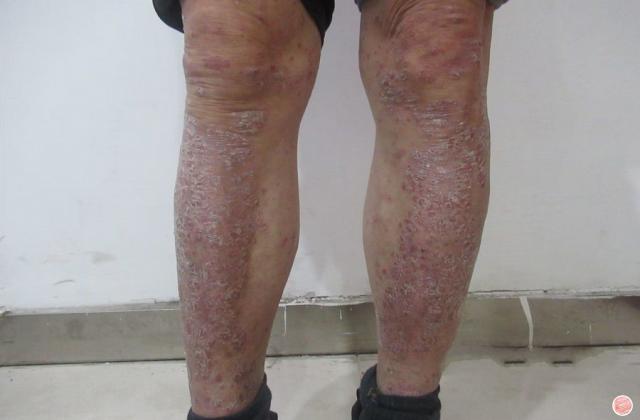
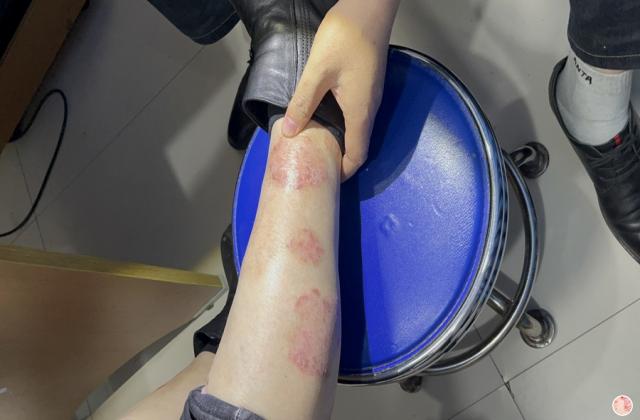
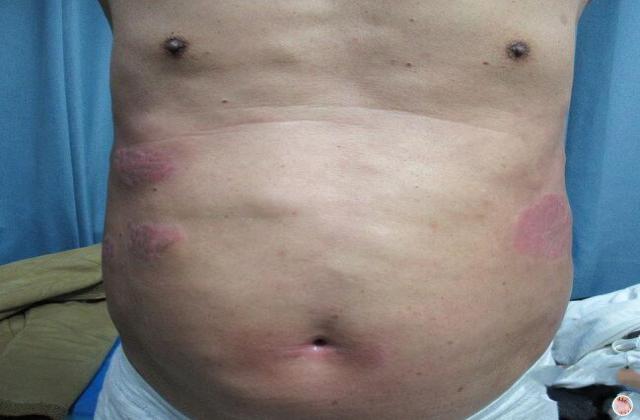
在已有指炎或附着点炎的患者中,使用risankizumab治疗可改善指炎和附着点炎。在同时患有斑块型银屑病的受试者中,接受risankizumab的治疗后,根据第24周的银屑病面积严重程度指数(PASI 90)进行测量,还观察到银屑病皮损的改善。
Risankizumab在PsA患者中的安全性与在斑块型银屑病患者中观察到的安全性一致。报告的最常见的不良反应是上呼吸道感染,头痛,疲劳,注射部位反应和癣感染。
宾夕法尼亚州邓肯斯维尔Altoona临床研究中心和Altoona关节炎和骨质疏松中心的创始人和医学主任,以及KEEPsAKE 临床试验研究员Alan J. Kivitz博士说:“在关键的KEEPsAKE试验中,证实Skyrizi可以改善银屑病关节炎的症状(包括关节疼痛、附着点炎和指炎)。此次批准为皮肤科医生和风湿病专家提供了一种新选择,有助于改善活动性银屑病关节炎患者的皮肤和关节症状,并且还可能为患者提供适合其生活方式的季度给药方案。”
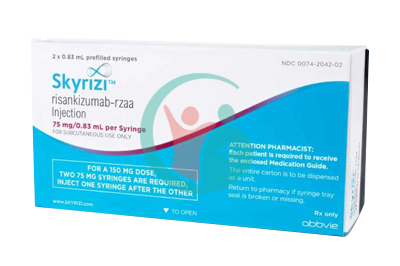
Skyrizi以150mg/mL单剂量笔,150mg/mL单剂量预充注射器,和75mg/0.83mL单剂量预充注射器(一盒2支注射器)的形式提供。经皮下注射技术培训后,患者可自行注射Skyrizi。
2019年3月26日,日本厚生劳动省(MHLW)批准SKYRIZI用于治疗对常规治疗缓解不足的斑块性银屑病、全身脓疱性银屑病、红皮病性银屑病和银屑病性关节炎成年患者。这次批准也是SKYRIZI的全球首次批准。
2019年4月23日,美国FDA批准SKYRIZI用于治疗接受过光疗或系统性治疗的中度至重度斑块性银屑病的成人患者。