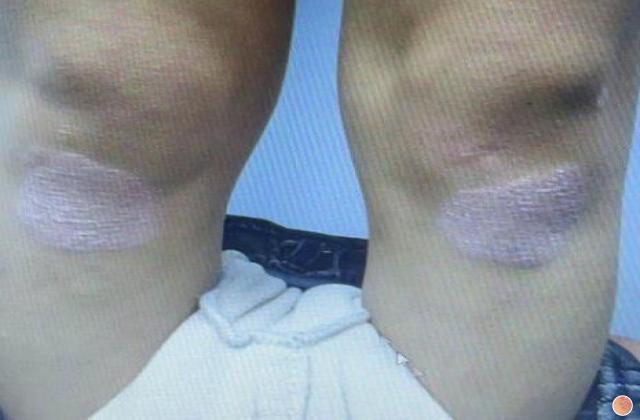
SPEVIGO® 在美国获得突破性疗法认定,用于预防全身性脓疱性银屑病发作

德国殷格翰——勃林格殷格翰今天宣布,spesolimab(以 SPEVIGO® 上市销售)获得美国食品药品监督管理局授予的突破性疗法认定(BTD),作为预防青少年和成人泛发性脓疱性银屑病(GPP)发作的研究性治疗药物管理局(美国食品药品监督管理局)。
勃林格殷格翰董事总经理兼人用制药负责人 Carinne Brouillon 表示:“GPP 突发事件可能会突然出现、迅速加剧,如果不及时治疗可能会危及生命,使受影响的人对他们的未来感到焦虑和不确定” . “FDA 认识到迫切需要预防 GPP 耀斑,这是朝着使患有这种疾病的人能够计划生活中的关键时刻迈出的重要一步,尽管他们患有疾病。”
该指定遵循中国国家药品监督管理局 (NMPA) 药品审评中心 (CDE),该中心最近还授予 spesolimab 预防 GPP 耀斑的 BTD。

美国 FDA 和中国 NMPA 根据 EFFISAYIL ™ 2 试验的主要结果授予这些名称,该试验研究了抗体 spesolimab 的长期治疗是否有助于预防长达 48 周的 GPP 青少年和成人的 GPP 发作。安全数据在与先前使用 spesolimab 进行的临床试验一致。试验数据将于 7 月初在 2023 年第 25 届世界皮肤病学大会上公布。
关于 spesolimab
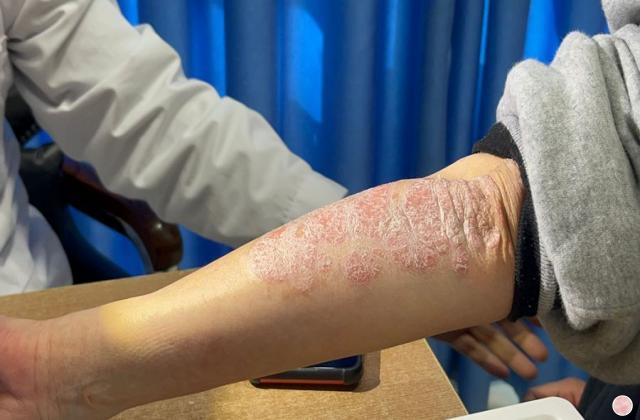
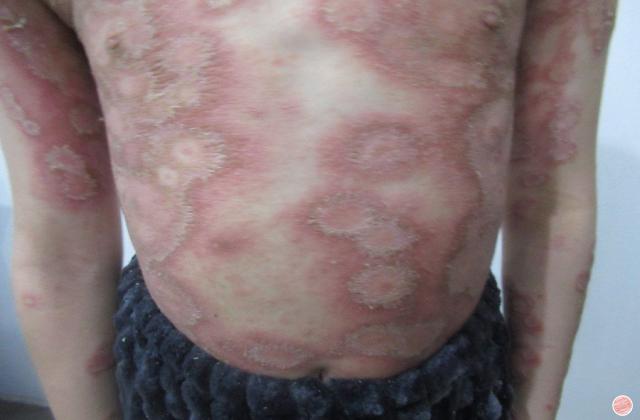
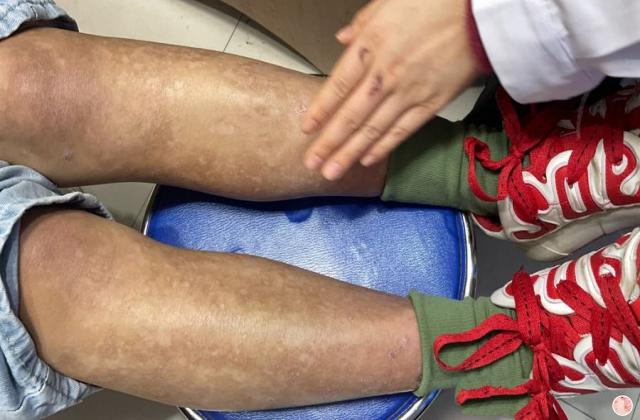
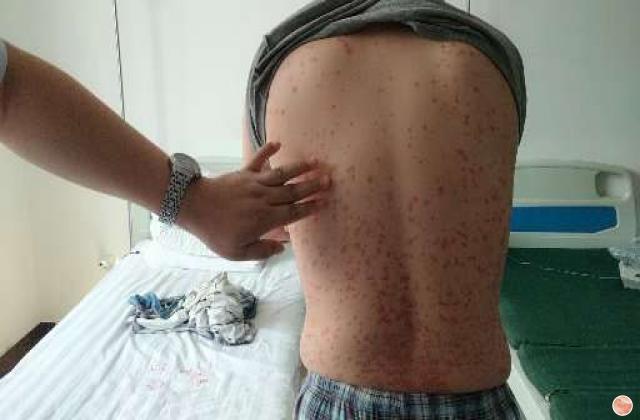
Spesolimab 是一种新型人源化选择性抗体,可阻断白细胞介素 36 受体 (IL-36R) 的激活,IL-36R 是免疫系统内的一种信号通路,已被证明与多种自身炎症性疾病(包括 GPP)的发病机制有关。 Spesolimab 已获得包括美国、日本、中国大陆和欧盟在内的近 40 个国家的监管机构批准,用于治疗成人 GPP 耀斑。
它是首个获批的专门针对 IL-36 通路的 GPP 耀斑治疗方法,并已在一项具有统计学意义的随机安慰剂对照试验中进行了评估。11 Spesolimab 也正在研究治疗其他 IL-36 介导的皮肤病疾病。
关于 EFFISAYILTM 临床试验项目
EFFISAYIL™ 临床试验计划包括:EFFISAYIL™ 1:一项 II 期研究表明,使用单次静脉内剂量的 spesolimab 治疗 GPP 发作患者可实现快速脓疱和皮肤清除,持续时间超过 12 周。11 这些结果支持批准 spesolimab (SPEVIGO®) 作为第一个主要市场成人 GPP 耀斑的特殊治疗。
EFFISAYIL™ 2:一项多中心、随机、双盲、安慰剂对照的 IIb 期研究,评估皮下 (SC) spesolimab 维持治疗在青少年和成人中预防 GPP 发作和持续控制 GPP 症状的有效性和安全性。
EFFISAYIL™ ON:一项开放标签的扩展研究,旨在评估 spesolimab 在已完成先前 spesolimab 试验的 GPP 患者中的长期安全性和有效性。