阿普斯特(Apremilast)获得FDA批准用于银屑病关节炎治疗
近日,美国食品药品监督管理局(FDA)宣布批准阿普斯特(Apremilast)用于治疗成人银屑病关节炎(PsA),成为全球首个获批用于该疾病的口服磷酸二酯酶-4(PDE4)抑制剂。此次批准标志着阿普斯特在银屑病领域的又一重要里程碑。
阿普斯特是一种口服的小分子药物,通过调控磷酸二酯酶-4(PDE4)的活性,从而降低细胞因子的产生和释放,从而减轻免疫系统的过度反应和炎症反应,发挥治疗作用。此前,阿普斯特已经被批准用于治疗银屑病(PsO)和口腔溃疡型李斯特曼病(BeHCet病)。

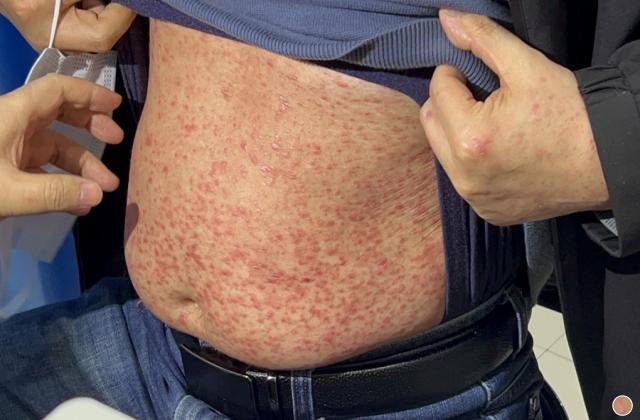
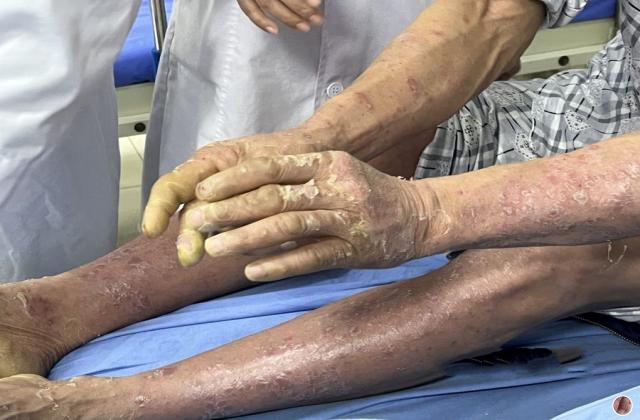
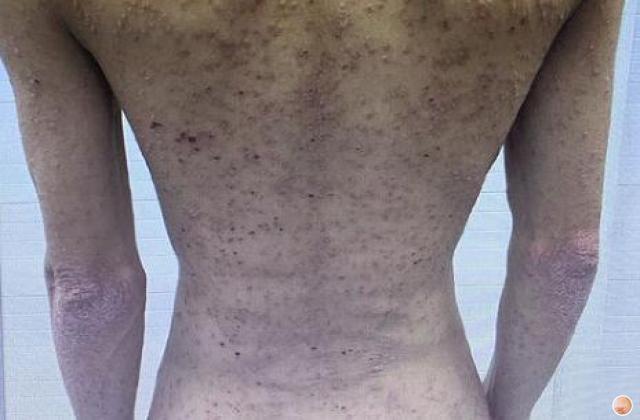
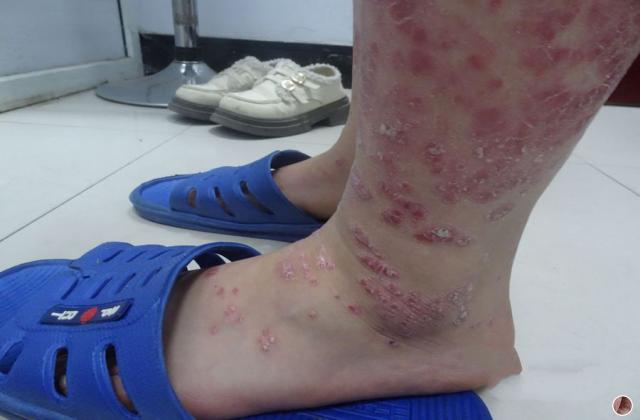
银屑病关节炎是一种慢性、炎症性的关节炎,一般成年人患者发病高峰期位于30-50岁,造成手指或脚趾肿胀、疼痛、僵硬等症状,极大影响患者的日常生活和生活质量。目前,市场上已有若干种治疗该疾病的药物,如生物制剂、非甾体类抗炎药、病理修复药等,但仍存在效果差、耐受性差、价格高等问题。
阿普斯特的批准颁布,为该疾病的治疗带来了新的希望和选择。此次批准依据两个II期和三个III期临床试验的结果,试验共涉及1493例患者,结果显示,阿普斯特治疗组的患者其肌肉骨骼疾病特定评定量(SPARCC)改善量和组织细胞病理学激活度指数(HAQ-DI)改善量显著高于安慰剂组,安全性良好。
值得一提的是,阿普斯特不仅在临床疗效上有优异表现,在安全性方面也表现出良好的特点,该药物在长达16周的临床试验中,未被发现明显不良反应。此外,与生物制剂相比,阿普斯特使用方便,流程简单,且效果相差不大。这也是该药物得到FDA批准的重要原因之一。
阿普斯特药物的研发、上市,不仅证明了中国制药企业在国际市场上获得越来越大的认可和声誉,更重要的是,为人类健康事业作出了积极的贡献。事实上,中国制药企业近年来在研发创新和海外拓展方面取得了大量成果,有望在全球化竞争的市场中占据更有利的地位,为国家社会的发展带来新的机遇和动力。