FDA批准苏金单抗用于治疗儿童斑块状银屑病
美国食品和药物管理局(FDA)已经批准白细胞介素-17抑制剂苏金单抗(secukinumab,Cosentyx)用于治疗6岁及以上儿童的中度至重度斑块状银屑病,这些儿童是系统治疗或光疗的候选者。此次扩大适应症标志着该药首次可以用于美国儿童患者。
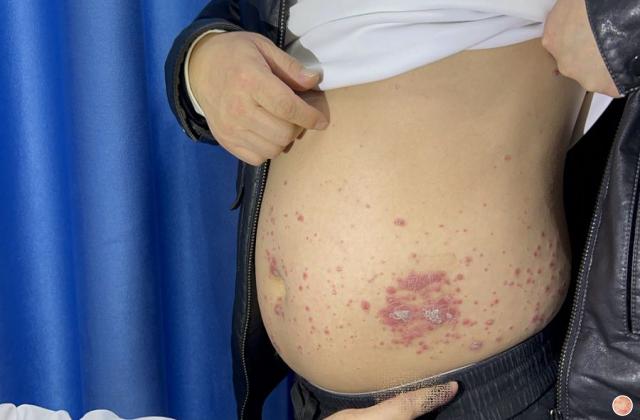
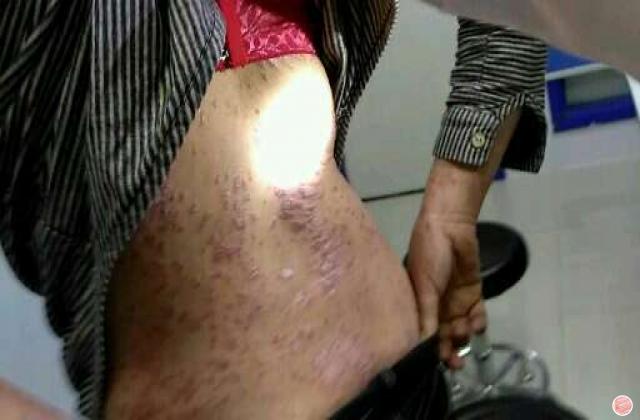
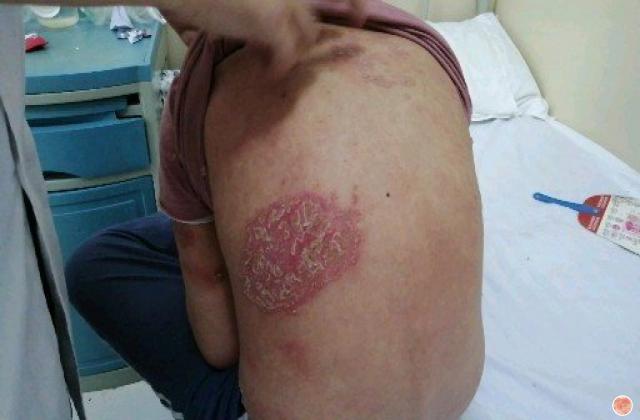
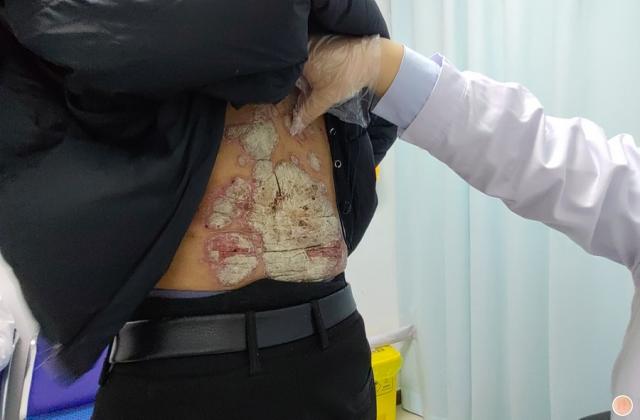
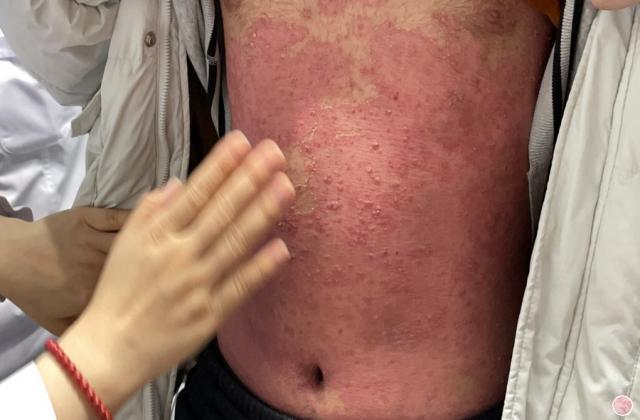
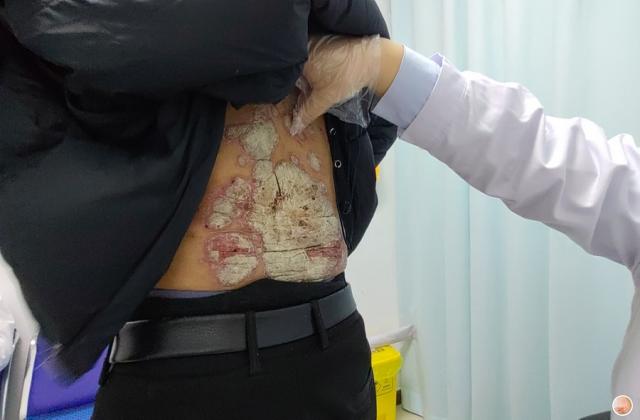
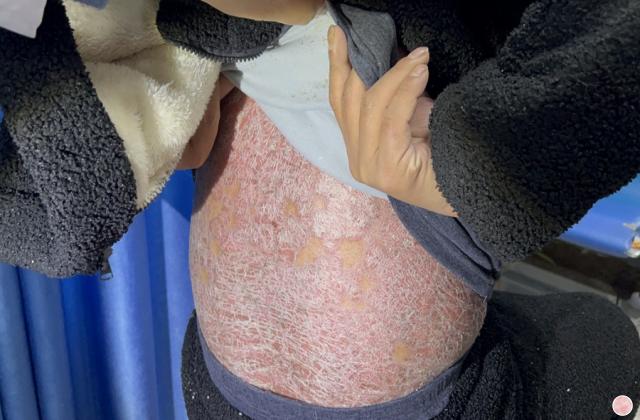
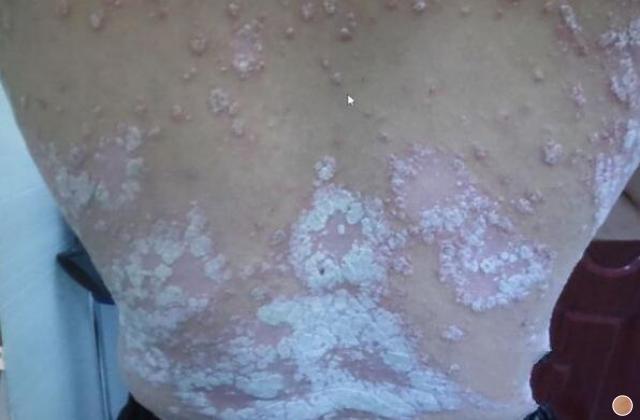
斑块状银屑病多数是由于遗传或慢性炎症所引起的,以肘、膝、头皮和下背部尤多见,也称为慢性斑块状银屑病。

瑞士诺华医药公司出品的苏金单抗是近几年来治疗银屑病效果显著的药物之一。苏金单抗于2015年1月份经美国FDA批准上市用于治疗接受全身治疗或光疗的成人患者中至重度斑块型银屑病,随后不久在瑞士、加拿大、英国、欧盟、日本、香港、新加坡、菲律宾、印度等地相继获批上市。
加州大学旧金山分校皮肤科和儿科教授Kelly M. Cordoro博士说:“由于害怕治疗的副作用,斑块状银屑病儿童通常得不到充分治疗。现在,越来越多的药物正在儿童身上进行安全性和有效性测试,我们不再需要依赖针对成年人的研究来为儿童提供治疗选择。”
苏金单抗的批准儿科剂量为75mg或150mg,取决于给药时儿童的体重,在初始负荷方案后,每4周皮下注射一次。
诺华公司表示,FDA的批准是基于两项3期试验的结果,这两项试验评估了苏金单抗用于治疗6岁至18岁斑块状银屑病儿童的疗效。第一项试验是一项为期52周的随机、双盲、安慰剂和主动对照试验,其中包含162名6岁及以上患有严重斑块状银屑病的儿童。体重小于50公斤的儿童的剂量为75mg,体重大于等于50公斤的儿童的剂量为150mg。
第12周时,75mg剂量组的银屑病严重程度指数(PASI)-75应答率为55%,安慰剂组为10%;150mg剂量组为86%,安慰剂组为19%。同时,研究人员全球评估2011修正版(IGA)“清除”反应率:75mg剂量组为32%,安慰剂组为5%;150mg剂量组为81%,安慰剂组为5%。IGA“几乎清除”反应率:75mg剂量组为81%,安慰剂组为5%。
第二项3期试验是一项随机、开放标签、为期208周的试验,包含84名6岁及以上中度至重度斑块状银屑病患者。这两个试验中报告的安全性与成人斑块状银屑病试验中报告的安全性一致,没有观察到新的安全性信号。
Cordoro博士说:“在考虑使用生物制剂等系统性药物进行治疗时,考虑病情严重程度的客观指标非常重要,如疾病程度和关节受累程度,但也要考虑严重程度的主观指标,如对心理健康的影响。由于尴尬或被欺负,银屑病发生在可见部位的患儿可能会在社交上孤立自己。因此,中度至重度银屑病不仅影响整体健康,而且会严重影响自尊和自我认知,因此,充分治疗各个年龄段的儿童,预防银屑病对儿童造成负面身心影响至关重要。”