每日一次口服治疗,Sotyktu于欧盟获批治疗成人银屑病

3月29日,百时美施贵宝(BMS)公司宣布,欧盟委员会批准了其自研药物Sotyktu(deucravacitinib)用于适合系统治疗的成人中重度斑块状银屑病患者。该药此前已获美国FDA批准用于治疗成年中重度斑块状银屑病患者,并已在中国申报上市。
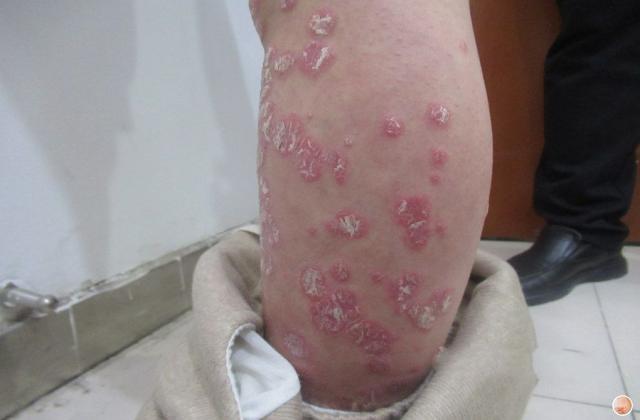
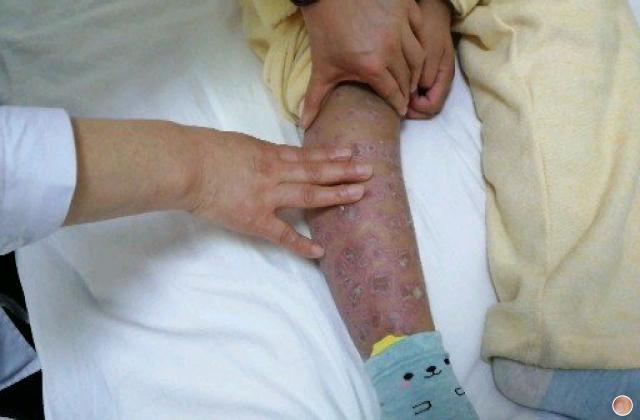
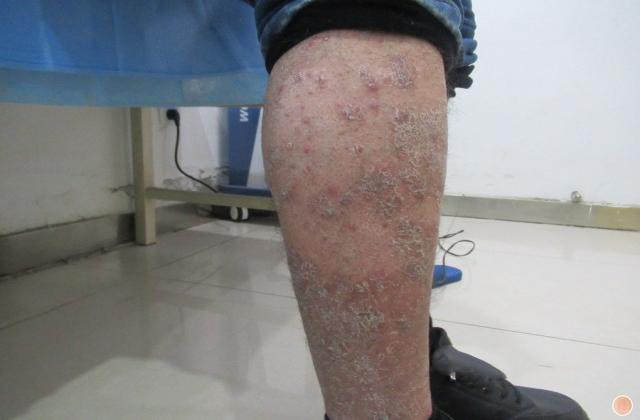
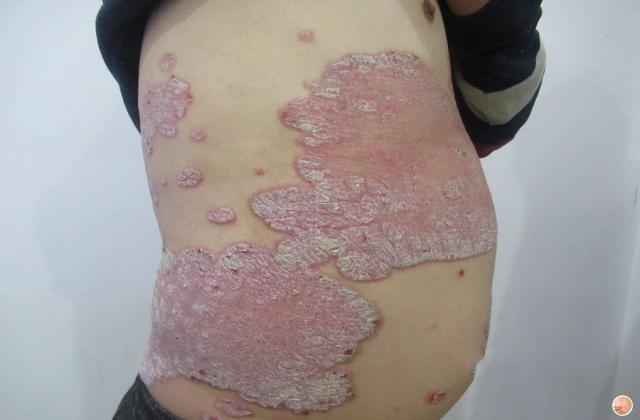
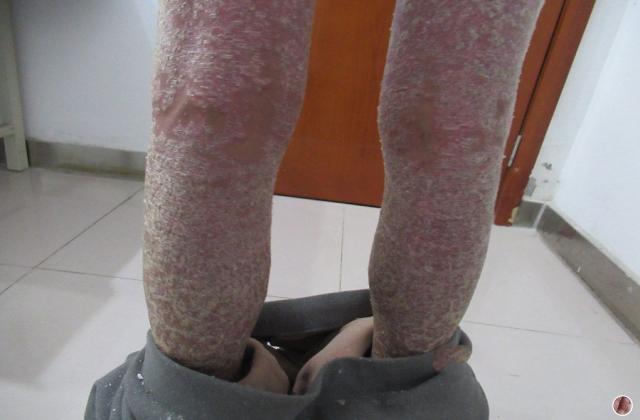
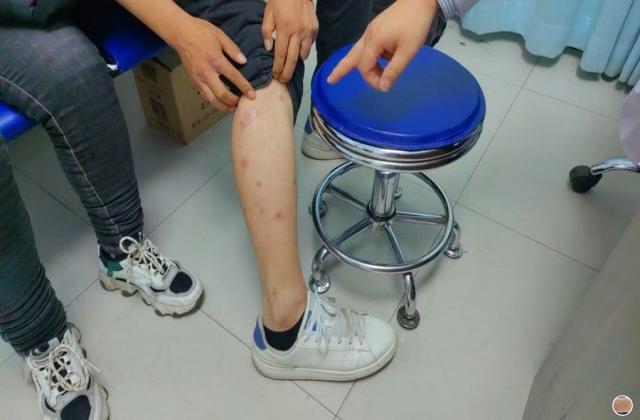
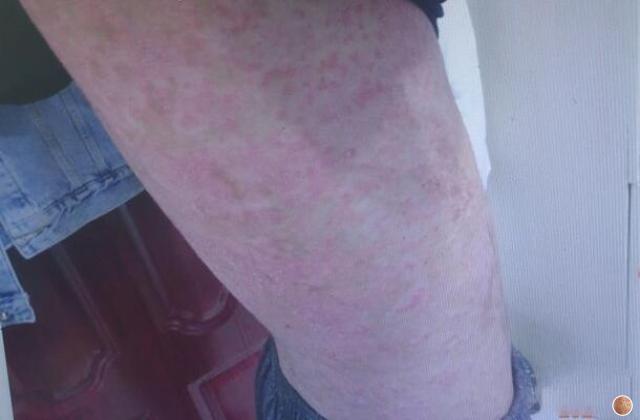
银屑病俗称牛皮癣,是一种慢性炎症性皮肤病,病程较长,有易复发倾向,有的病例几乎终生不愈。该病发病以青壮年为主,对患者的身体健康和精神状况影响较大。此外,银屑病可能会使其他严重疾病的风险增加(如心血管疾病)。大量研究证明银屑病是免疫介导的炎症性皮肤病,其发病与炎症细胞浸润和炎症因子有关。
Deucravacitinib是一种一流的口服选择性别构酪氨酸激酶2(TYK2)抑制剂,也是全球唯一批准的TYK2抑制剂。该药物是近10年来中度至重度斑块型银屑病口服治疗的首次创新。TYK2是一种细胞内信号激酶,能够介导白细胞介素(IL)-23、IL-12、I型干扰素(IFN)的信号传导,这些细胞因子是参与炎症和免疫反应的天然细胞因子。不同于已上市的JAK抑剂,deucravacitinib通过独特的“变构抑制”机制,与TYK2调节结构域结合抑制其活化,从而阻断由其介导的下游细胞信号通路及免疫反应,进而避免相关心血管事件或静脉血栓栓塞不良事件的发生。

本次deucravacitinib在欧盟获批是基于3期POETYK PSO-1临床研究和POETYK PSO-2临床研究的结果。两项试验分别纳入了666例患者和1020例患者,旨在评估deucravacitinib对比阿普米司特和安慰剂治疗中重度斑块状银屑病成人患者的疗效和安全性。共同的主要终点为第16周时银屑病面积与严重性指数(PASI)评分改善75%以上和sPGA 0/1(静态医生总体评估皮肤症状完全清除/几乎完全清除)的患者比例。关键次要研究终点包括与对照药相比,在第16周达到PASI 75、PASI 90和sPGA 0/1的患者比例,以及评deucravacitinib对比安慰剂和对照药的其他指标。
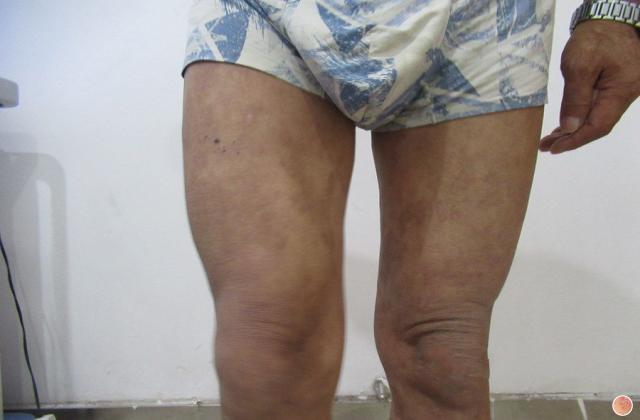
数据显示,第16周时,与安慰剂组和阿普米司特组相比,deucravacitinib组在两项试验中的PASI 75(银屑病面积与严重程度指数改善至少75%)的患者比例分别为58.7%和53.6%,而安慰剂组和阿普米司特组分别为12.7%和9.4%,以及35.1%和40.2%。同时,试验还达到了所有次要终点,deucravacitinib在症状负担和生活质量测量值上表现出显著且具有临床意义的改善。此外,deucravacitinib耐受性良好,因不良反应导致的停药率低。
此外,POETYK PSO长期扩展(LTE)试验数据也为此次获批提供支持。2022年5月,百时美施贵宝公司公布了POETYK PSO-LTE试验的两年结果。结果显示,该药临床疗效在长达两年的研究中持续保持,在试验第60周,达到PASI 75和sPGA 0/1的患者比例分别为77.7%和58.7%。
POETYK PSO-1试验临床研究员、南加州大学皮肤病学副院长兼教授April Armstrong博士评论:“Sotyktu有可能成为中度至重度斑块型银屑病患者口腔护理治疗的新标准,该疗法它有助于患者获得更清洁的皮肤,这一点在POETYK PSO临床项目中得到证实。患有中度至重度斑块型银屑病的人面临着日常生活中巨大的负担,而Sotyktu可成为这些患者首选的一线全身治疗选择。”